استخراج مستقیم لیتیوم (Direct Lithium Extraction) یا به اختصار DLE، روشی جایگزین در مقابل راههای مرسوم استخراج این عنصر است. در روشهای معمول، استخراج از طریق انجام چندین مرحله واکنش شیمیایی و جداسازی ناخالصیها به کمک رسوبدهی آنها آنجام میگردد. اما در استخراج مستقیم، بدون نیاز به انجام فرآیندهای حذف ناخالصیها، لیتیوم بصورت انتخابی از محیط استخراج میگردد. هدف فناوریهای استخراج مستقیم، مقابله با کاستیهای محیطی و فنی-اقتصادی فناوری تبخیری است. در حالت ایده آل، استخراج مستقیم باید به طور کامل از حوضچه های تبخیر هوای باز جلوگیری کند.
اصول کلی کار استخراج مستقیم
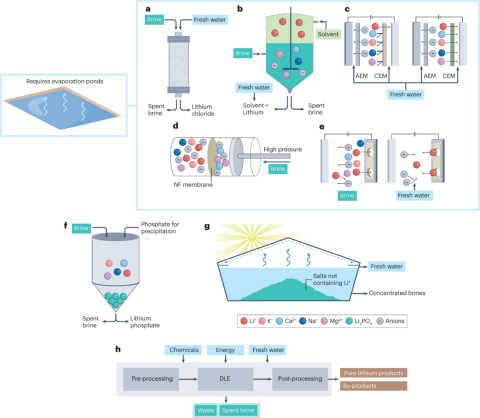
فناوری های استخراج مستقیم را میتوان به هفت دسته کلی طبقه بندی کرد (شکل 1).
شکل 1: فنآوری های استخراج مستقیم لیتیوم (DLE) (منبع عکس)
توضیحات عکس:
- بخش a: ورودیهای آب شیرین و تولید آب نمک مصرف شده.
- بخش b: رزینهای تبادل یونی که به عنوان غربالهای یونی یا جاذبهای خاص نیز شناخته میشوند.
- بخش c: استخراج با حلال یا مایع-مایع.
- بخش d: فرآیندهای الکتروغشایی با غشاهای انتخابی +Li (سمت چپ) یا غشاهای انتخابی نفوذپذیر (سمت راست) که نسبت به آنیونها یا کاتیونها انتخابی هستند.
- بخش e: نانوفیلتراسیون
- بخش f: پمپاژ یون الکتروشیمیایی، که گاهی اوقات درج یون الکتروشیمیایی یا تبادل یون قابل تعویض الکتروشیمیایی نیز نامیده می شود.
- بخش g: بارش انتخابی Li3PO4از طریق افزودن Na3PO4
- بخش h: روشهای حرارتی برای غلظت آب نمک، به غیر از تبخیر در هوای آزاد. این روشها شامل هر نوع اوپراتور، دستگاه تقطیر یا تقطیر غشایی است
روش 1، رزینهای تبادل یونی
رزینهای تبادل یونی (شکل 1a) موادی هستند که میل ترکیبی بالایی با کاتیونهای +Li ، دارند ، و این کاتیونها را بر روی ذرات کوچک رزینی (اغلب در ستونها) خود جذب میکنند. این امر حتی در غلظتهایی بسیار پایین کاتیونهای +Li در مقایسه با سایر یونهای حاضر در محیط نیز قابل انجام است. محلولهای آب شیرین یا اسیدی معمولاً برای دفع کاتیونهای +Li از رزینها برای تولید محلول +Li نسبتاً خالص (معمولا محلول LiCl) استفاده میشوند.
روش 2، استخراج حلالی
حلالهای آلی نظیر tri-n-butylphosphate و مایعات یونی مانند Imidazole تمایل بالایی به جذب یونهای لیتیوم در ساختار خود دارند. در اثر قرارگیری شورآبهی حاوی لیتیوم با این ترکیبات، لیتیوم جذب آنها میشود. در مرحلهی بعدی و با ترکیب این حلالهای غنی از لیتیوم با آب، میتوان لیتیوم را با حداقل ناخالصی از حلال جدا کرد (شکل 1b).
روش 3، روش غشایی
روش دیگر، فرآیندهای غشایی برای بازیابی انتخابی لیتیوم میتوانند توسط میدانهای الکتریکی (شکل 1c) یا نیروهای مکانیکی (شکل 1d) هدایت شوند . استفاده از میدانهای الکتریکی معمولاً به غشاهایی نیاز دارد که برای آنیونها یا کاتیونهای انتخاب شوند (شکل 1c، سمت راست)، با تعداد کمی از غشاها انتخابپذیریهای خاص را نشان میدهند (شکل 1c ، سمت چپ). نیروهای مکانیکی برای راندن آب نمک ها در سراسر غشاهای نانوفیلتراسیون استفاده میشود، با گونه های چند ظرفیتی معمولاً حفظ میشوند .
روش 4، نانوفیلتراسیون
در این روش، با استفاده از فیلترهایی حاوی تخلخلهایی با ابعاد نانو و به کمک اعمال نیروی مکانیکی به شورآبه، میتوان یونهای لیتیوم را بصورت انتخابی از مواد اولیه جدا ساخت. اعمال میدان الکتریکی به همراه استفاده از فیلترهایی که قابلیت جدایش انتخابی آنیون و کاتیونها را دارند نیز یکی از راههای جدایش لیتیوم به کمک فیلتر است (شکل 1c و 1d).
روش 5، پمپاژ الکتروشیمیایی
در پمپاژ یونی الکتروشیمیایی، +Li در یک ماده الکترود تحت یک گرادیان پتانسیل قرار میگیرد (شکل 2e ، سمت چپ)، و در یک واکنش الکتروشیمیایی شرکت میکند. در این روش هیچ ماده شیمیایی مورد نیاز نیست و هیچگونه محصول جانبی به پسماند آب نمک اضافه نمیشود. متعاقباً، +Li با استفاده از محلولهای بازیابی که نیاز به آب تازه دارند، از مواد الکترود خارج میشود و محلول LiCl رقیقشده تولید میکند (شکل 2e ، سمت راست). پمپاژ یون الکتروشیمیایی اغلب به همراه غشاهای انتخابی یونی استفاده میشود .
روش 6، رسوب انتخابی
رسوب انتخابی (شکل 1f) بر اساس حلالیت بسیار کم لیتیوم فسفات (Li3PO4) در آب است. بخش بزرگی از +Li موجود در آب شور را اغلب میتواند با افزودن فسفات های مختلف بازیابی کرد، مشروط بر اینکه آب نمک قبلاً از گونه های چند ظرفیتی تخلیه شده باشد .
روش 7، روشهای حرارتی (تبخیر یا تقطیری)
آخرین روش استخراج مستقیم، شامل فرآیندهایی است که در آنها هدف اصلی تغلیظ شورآبهی اولیه و بازیابی همزمان آب است.در روش مرسوم نیز از تبخیر آب برای افزایش غلظت حوضچههای آب شور استفاده میشود، با این تفاوت که در روش مرسوم آب تبخیر شده در جو از بین میرود. نمونه هایی از این فرآیندها عبارتند از تقطیر غشایی و تبخیر کنندههای خورشیدی (شکل 1g).
پایداری و مقیاس پذیری بالقوه هفت روش استخراج مستقیم شکل (1a تا 1g) برای جذب یا تغلیظ کاتیونهای +Li در شکل 2 قابل مشاهده است. جذب یا غلظت یون های +Li یک مرحله پردازش بسیار مهم است. با این حال، پیش پردازش آب نمک بومی به عنوان مثال، گرم کردن یا تنظیم pH آب نمک، برای اجرای صحیح استخراج مستقیم مورد نیاز است. علاوه بر این، بیشتر فناوریهای پیشنهادی استخراج مستقیم مستقیماً یک محصول لیتیوم خالص تولید نمیکنند، بلکه یک محلول خالص شده تولید میکنند. بنابراین نیاز به پردازش ثانویه دارد (شکل1h).
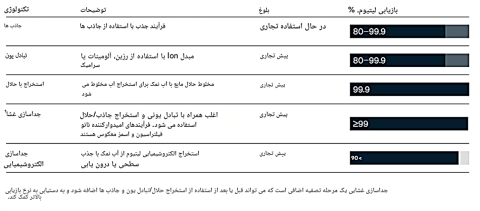
شکل 2. بازدهی فناوری های مختلف استخراج مستقیم لیتیوم
چشم اندازهای آینده
برخی از رویکردهای پیشنهادی استخراج مستقیم ، مانند پمپاژ یونی یا غشاهای انتخابی +Li ، کاملاً جدید هستند و برای رسیدن به مقیاس صنعتی به تلاشهای مهندسی بیشتری نیاز دارند. در مقابل، روشهای دیگر، مانند تبادل یونی، استخراج با حلال یا فرآیندهای الکتروغشایی، برای دههها در فرآیندهای مهندسی شیمی جداسازی صنعتی مرتبط مورد مطالعه قرار گرفتهاند، و چالش در اینجا تطبیق این روشها با پیچیدگی آب نمکهای غنی از لیتیوم است. بررسیهای آزمایشگاهی با آبشور واقعی یا محلولهایی که ترکیب شیمیایی مشابه با آبشور موجود در معادن دارند، برای افزایش سطح آمادگی این فناوریها بسیار مهم هستند. نکته مهم دیگر هنگام افزایش مقیاس از مقیاس آزمایشگاهی به صنعتی، حجم عظیم آب نمک است که باید روزانه پردازش شود. تجزیه و تحلیل انجام شده در مقیاس آزمایشگاهی در محدوده های وسیع pH و دما، تحقیقات آکادمیک جالبی را انجام می دهد، اما کمتر به اجرای فناوری کمک می کند. علاوه بر این، موقعیت دور و خشکی محیطهای حاوی لیتیوم، مشکلات لجستیکی ایجاد میکند و هزینههای اضافی در حمل و نقل مواد شیمیایی، تأمین انرژی دور از شبکه و تأمین منابع کمیاب آب شیرین ایجاد میکند.
در حالت ایده آل، استخراج مستقیم باید به طور کامل از تبخیر آب نمک در حوضچه ها جلوگیری کند و در نتیجه اتلاف آب کمتری نسبت به فناوری تبخیری داشته باشد. در فعالیتهای تحقیقاتی، اغلب تولید محلول های LiCl یا LiOH نسبتاً خالص به جای یک محصول لیتیوم جامد گزارش می شود. این امر نشان می دهد حوضچههای تبخیر ممکن است هنوز برای تکمیل برخی از فناوری های استخراج مستقیم ضروری باشند.
اهمیت غلظت لیتیوم
غلظت +Li که می تواند از طریق رویکردهای مختلف استخراج مستقیم به دست آید جنبه دیگری است که به ندرت گزارش می شود. برای مقایسه، در فناوری تبخیری، رسوب تنها در غلظتهای لیتیوم بیشتر از 5-6 گرم در لیتر انجام میشود . حتی در این غلظت ها، درصد زیادی از +Li بازیابی نمی شود و پساب ها برای تبخیر بیشتر به حوضچه ها فرستاده می شوند. استخراج مستقیم باید محلول هایی با غلظت +Li بیشتر از 25 گرم در لیتر تولید کند ، در غیر این صورت یک روش غلیظسازی اضافی ضروری خواهد بود. روشهای حرارتی برای تغلیظ محلولها پرهزینه هستند. بنابراین، اگر استخراج مستقیم محلولهای رقیقشده با LiCl تولید کند، احتمالاً از تبخیر در هوای آزاد استفاده میشود که منجر به مشکلات مشابه با فناوری تبخیری میشود.
افزایش قیمت ها و تقاضای بالای ترکیبات لیتیوم، پتانسیل منابع شورآبه های مرسوم و منابع زمین گرمایی را به عنوان منابع دیگر مواد خام مهم پنهان کرده است. به دنبال مفهوم چرخهی اقتصادی (Circular Economy)، روش های استخراج جدیدی باید توسعه یابد که بازیابی همزمان یا متوالی چندین محصول جانبی را در نظر بگیرد. بازیابی همزمان هر چه بیشتر محصولات جانبی مقادیر کمتری زباله تولید خواهد کرد. برداشت انرژی و بازیابی همزمان محصولات لیتیوم در میادین آب شور زمین گرمایی (Geothermal) ممکن است مزایای مشابهی به همراه داشته باشد. در این زمینه میتوان از دانش پیشین موجود در حوزهی نمکزدایی از آب دریا برای تولید آب آشامیدنی نیز استفاده کرد.
در مقالات آینده، به اثرات زیست محیطی استخراج لیتیوم آلودگیهای ناشی از آن پرداخته خواهد شد.
برای ارجاع به منبع این مقاله، کلیک نمایید.