مقدمه
باتریهای لیتیوم-هوا (Li-O2) به علت ظرفیت تئوری بالای آنها بسیار مورد توجه قرار گزفته اند و به عنوان جایگزین اصلی برای باتریهای لیتیوم-یون مرسوم معرفی شده اند.باتریهای لیتیوم-یون (LIB) یکی از رایج ترین سیستمهای ذخیره سازی انرژی هستند که میتواند انرژی الکتریکی را به صورت برگشت پذیر به انرژی شیمیایی تبدیل کنند. با این حال، LIBهای مرسوم به دلیل ظرفیت تئوری کم و توسعه سیستمهای ذخیره سازی جدید، نمیتوانند به عنوان سیستم ذخیره سازی مطلوب باقی بمانند. در دهه گذشته، باتریهای لیتیوم -هوا قابل شارژ، به دلیل چگالی انرژی تئوری فوق العاده بالا توجه جهانی را برانگیخته اند و به یکی از کاندیداهای رقابتی برای جایگزینی LIBها تبدیل شده اند. با این حال، بسیار مهم است که به بیشینه ظرفیت همراه با پایداری سیکلی مناسب برسیم که چندین دهه مانع کاربرد باتریهای لیتیوم-هوا شده است. اگرچه دستاوردهای امید بخشی در سالیان گذشته بدست آمده، اما همچنان مسائل حل نشدنی زیادی برای کاربرد باتریهای لیتیوم-هوا وجود دارد.
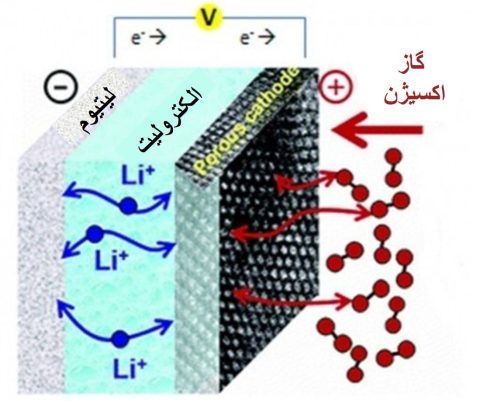
در حال حاضر چندین نوع از باتریهای لیتیوم-هوا گسترش پیدا کرده است و بر اساس نوع الکترولیت مورد استفاده در آنها به چهار نوع تقسیم میشوند. این دسته بندی شامل الکترولیتهای غیر آبی (حاللهای آلی و مایعات یونی)، آبی، باتریهای هیبریدی و حالت جامد میشود. که در میان این چهار نوع، بیشتر تحقیقات به علت چگالی انرژی نسبتاً بالا همراه با ساختارساده باتری، روی الکترولیتهای غیر آبی تمرکز کرده اند. ساختار باتریهای Li-O2 غیرآبی بسیار شبیه نیم سل های لیتیوم-یون است و هردو شامل فلز لیتیوم به عنوان آند، جدا کننده، الکترولیت و کاتد هستند با این تفاوت که کاتدهای باتری لیتیوم-هوا در معرض اتمسفر/اکسیژن قرار دارد. اگرچه مکانیزم تعاملات یون لیتیوم در باتریهای Li-O2 و باتریهای لیتیوم-یون با یکدیگر متفاوت است. باتریهای Li-O2 سیستمهای نیمه-باز هستند که از اکسیژن محیط به عنوان منبع نگهداری و تبدیل انرژی استفاده میکنند. در فرآیند دشارژ، فلز لیتیوم به یون لیتیوم دی اکسید تبدیل میشود و سپس به سمت کاتد هوا حرکت میکند. در همین حال اکسیژن در مدار خارجی یک الکترون میگیرد و با یون لیتیوم ترکیب میشود تا محصوالت فرآیند دشارژ را روی کاتد هوا تشکیل دهد. هنگام شارژ شدن باتری، واکنشهای الکتروشیمیایی برعکس حالت دشارژ اتفاق میافتد. معمولا محصول اصلی واکنش دشارژ در باتریهای Li2O2 ،Li-O2 است.
با این حال، توسعه باتریهای Li-O2 هنوز در مرحله اولیه خود است. برخی از موانع مهم برای کاربرد عملی باتریهای Li-O2 شامل راندمان انرژی پایین، عمرسیکلی کوتاه و نرخ پذیری ضعیف این باتریها میباشد. این اشکالات عمدتاً به علت سرعت کم واکنش کاهشی اکسیژن (ORR) و واکنش تکمیلی اکسیژن (OER) و انتقال جرم کم روی کاتد میباشد. به همین جهت، تحقیقات زیادی به منظور پیدا کردن کاتدهای جدید با واکنشهای سری ORR و OER به منظور آسانتر شدن سینتیک فرآیند تمرکز کرده اند. همچنین برای جبران انتقال جرم کم، به ساختارهای با تخلخل کافی نیاز است. لذا دستیابی به کاتدهای کارآمد با نانوساختارهای متخلخل منحصر به فرد ، بسیار مورد توجه قرار گرفته است. اگرچه کاتدها نقش بسیار مهم ی در کل سیستم دارند، به سختی میتوان گفت که کاتدها تنها ایراد باتریهای Li-O2 هستند.
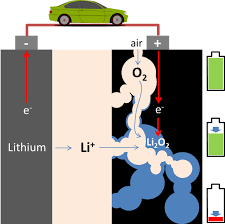
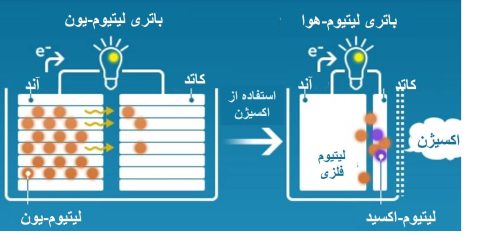
شکل 1. تفاوت باتری لیتیوم-یون و لیتیوم-هوا
کاتد باتریهای Li-O2
بدیهی است، کاتد به عنوان محل اصلی برای واکنشهای الکتروشیمیایی نقش اساسی دارد. به علت سیستم نیمه- باز و مکانیزم پیچیده واکنش باتریهای Li-O2،الزامات منحصر به فردی در هنگام طراحی کاتد باید در نظر گرفته شود. در کاتد به طور خالصه باید به سه فاکتور اصلی توجه شود: فعالیت کاتالیستی بالا، هدایت الکترونیکی بالا و تخلخل زیاد. در مرحله اول، مواد کاتدی باید فعالیت کاتالیستی بالایی داشته باشند تا فرآیندهای کُند ORR و OER را تسهیل کنند و بنابراین میتوانند پتانسیل اضافی باتریهای Li-O2 را کاهش دهند. در مرحله دوم، هدایت الکترونیکی بالا لازم است تا الکترونهای کمکی برای واکنشهای سریع الکتروشیمیایی تهیه کند. از آنجایی که محصوالت دشارژ در کاتد تولید و ذخیره میشود، سومین فاکتور مورد نیاز تخلخل زیاد است. به علاوه، تخلخل زیاد همچنین میتواند انتقال جرم سریع و نفوذ کافی الکترولیت را حفظ کند. اصوالًا، مواد کاتدی را میتوان به سه گروه مواد پایه کربنی، مواد پایه فلزی گرانبها و مواد پایه فلزی ارزان قیمت تقسیم کرد.
مواد پایه کربنی
مواد پایه کربنی به دلیل داشتن بسیاری از مزایای جذاب از جمله وزن سبک، هزینه کم، هدایت بالا، مساحت سطح ویژه بالا و ساختار با تخلخل قابل تنظیم، همواره مورد توجه قرار داشته اند. به همین دلیل مواد پایه کربنی به طور گسترده ای مورد بررسی قرار گرفته و در بسیاری از دستگاه های ذخیره سازی انرژی از قبیل باتریهای لیتیوم – یون، باتری سدیمی و ابررساناها مورد استفاده قرار گرفته اند. عالوه بر این، در مواد پایه کربنی با دوپینگ اتمهای گوناگون میتوان سرعت هر دو واکنش OER/ORR را تسریع کرد که آنها را به یکی از امیدوارکننده ترین مواد کاتدی باتریهای Li-O2 تبدیل میکند.
کربن فعال
کربن فعال به عنوان ماده افزودنی رسانا در باتریها بطور گسترده ای مورد استفاده قرار میگیرد و از نظر تجاری نیز در دسترس است. صرف نظر از مزایای استفاده آن مانند هزینه کم و هدایت الکتریکی بالا، کربن فعال همچنین مساحت سطح ویژه بسیار بالایی را پردازش میکند که یکی از مهمترین فاکتورها برای کاتد در باتریه ای لیتیوم-هوا است. در حال حاضر انواع مختلف کربن فعال مانند Ketjenblack ،Super P ،XC-72 ،BP2000 ،Calgon ،black Denda و JMC به عنوان کاتد در باتریهای Li-O2 مورد استفاده قرار میگیرند.
مواد کربنی پیشرفته
همانطور که ذکر شد، مواد کاتدی باتریهای Li-O2 سطح ویژه بالا و تخلخل مناسب احتیاج دارند. کاهش ابعاد مواد یکی از راهبردهای امیدوارکننده برای افزایش سطح ویژه و ساخت ساختارهای متخلخل مختلف است. مواد کربنی با بعد کم از جمله شکلهای یک بعدی مانند نانولوله های کربنی (CNTs )و نانوالیاف کربن(CNFs )و شکلهای دو بعدی مانند گرافن به طور گستردهای مورد استفاده قرار گرفته اند. مواد کربنی پیشرفته به دلیل وجود ساختارهای منحصر به فرد، فعالیت بالای الکتروشیمیایی برای باتریهای Li-O2 بسیار مناسب هستند. گرافن به دلیل ساختار و خواص بی نظیر خود در بسیاری از زمینه ها، به ویژه به عنوان الکتروکاتالیستها و مواد ذخیره سازی انرژی، عملکردهای خارق العادهای از خود نشان داده است. گرافن به علت رسانایی الکتریکی و مساحت سطح ویژه بالا به خوبی میتواند به عنوان کاتد در باتریهای Li-O2 عمل کند.
مواد کربنی با ساختارهای ویژه
با تحقیقات در حال رشد باتریهای لیتیوم-هوا، نیازهای اولیه برای ساختار مواد کاتدی به تدریج برقرار شده است. ساختارهای با تخلخل های تناوبی مزو و ماکرو میتوانند به طور موثر عملکرد باتریهای Li-O2 را بهبود بخشند. تاکنون باتوجه به توسعه سریع فناوری نانو، بسیاری از مواد کربن با ساختاری ویژه برای باتریهای Li-O2 طراحی و تهیه شده اند. برای مثال، Guo و همکارانش از سیلیس به عنوان قالب برای تهیه کره های کربنی منظم با تخلخل های منظم مزو/میکرو (MMCSAs) برای باتریهای Li-O2 استفاده کردند و ظرفیت بیشتری نسبت به اکسید گرافن تجاری (GO) یا CNTها بدست آوردند .
شکل 2. استفاده از کربن متخلخل به عنوان کاتد باتری لیتیوم-هوا
مواد بر پایه فلزات گرانبها
فلزات گرانبها کاتالیزورهای مهمی برای واکنشهای ORR و OER هستند. بنابراین، میتوانند ایده مناسبی برای استفاده از آنها به عنوان مواد کاتدی در باتریهای Li-O2 باشند. تاکنون بسیاری از مطالعات، برتری فلزات گرانبها و اکسیدهای آنها از جمله طلا، پلاتین،، مس و ایریدیوم را نشان داده اند. پنگ و همکارانش از طلا با تخلخل نانومتری به عنوان کاتد و دی متیل سولفوکسید (DMSO) ) به عنوان الکترولیت استفاده کردند و دریافتند که سینتیک فرآیند شارژ حدود 10 برابر سریعتر از الکترودهای کربنی است. عالوه بر این، کاتدهای بر پایه فلز گرانبها میتوانند overpotential را در باتریهای Li-O2 (نه تنها به واسطه فعالیت کاتالیزوری بالا، بلکه همچنین با تغییر مورفولوژی و ساختار کریستالی محصوالت دشارژ) کاهش دهند.
مواد پایه فلزی ارزان قیمت
اگرچه دستاوردهای تحسین برانگیزی با استفاده از کاتدهای برپایه فلزات نجیب در کاهش overpotential باتریهای Li-O2 حاصل شده است، اما هزینه بالای فلزات گرانبها یک اشکال اجتناب ناپذیر است که کاربردهای عملی آنها را به طرز چشمگیری محدود کرده است. برای جایگزینی فلزات نجیب، بسیاری از محققان استفاده از مواد بر پایه فلزات واسطه ارزان قیمت مانند فلزات، اکسیدها، کاربیدها، نیتریدها، سولفیدها و کامپوزیت های آنها، به عنوان کاتد در باتریهای Li-O2 را انتخاب کرده اند.
آند باتریهای Li-O2
چگالی انرژی بالاتر و پایداری سیکلی بیشتر اهداف نهایی سیستمهای ذخیره سازی انرژی هستند. در باتریهای Li-O2، اکسیژن را میتوان به صورت نامحدود از هوا تهیه کرد، بنابراین به طور عمده ظرفیت باتری به مقدار لیتیوم تولیدی توسط آندها بستگی دارد. فلز لیتیوم به عنوان آند دارای بالاترین ظرفیت تئوری( 3860 میلی آمپر ساعت بر گرم) و کمترین پتانسیل الکتروشیم یایی (04/3 -ولت) در مقابل الکترود هیدروژن استاندارد را دارد، که میتوانند چگالی انرژی باتریهای لیتیوم-هوا را به حداکثر برسانند. با این حال، آندهای فلز لیتیوم دارای چالشهای زیادی هستند که باید قبل از کاربرد عملی آنها حل شود. آندهای فلزی لیتیوم برای باتریهای Li-O2 نیز با همان مشکلاتی که در باتریهای لیتیوم-یون سنتی وجود دارد، روبرو هستند. از جمله این مشکالت میتوان به رشد دندریتی لیتیوم، لایه بین فازی الکترلیت جامد (SEI) و تغییرات حجمی زیاد اشاره کرد. آندهای فلز لیتیوم در باتریهای Li-O2 ،به دلیل واکنشهای الکتروشیمیایی منحصر به فرد و پیکربندی نیمه باز با چالشهای ویژهای روبرو هستند. واکنشهای موجود بین لیتیوم و اکسیژن از طرف کاتد به طور چشمگیری باعث کاهش راندمان کولومبیک و پایداری سیکلی آند لیتیومی میشوند. خوشبختانه ، با درک روزافزون از باتریهای Li-O2، اهمیت آندهای لیتیومی به تدریج روشن شد و استراتزی ساخت غشای (فیلم محافظ) روی آندهای فلزی لیتیومی به طور گستردهای استفاده شد. این استراتژی را میتوان به دو نوع تقسیم کرد: فیلمهای SEI و فیلمهای مصنوعی. برای روش اول ، متداول ترین روش افزودن افزودنیهای الکترولیتی برای تشکیل یک فیلم SEI پایدار بود. به عنوان مثال، LiNO3 گزینه مناسبی برای تشکیل یک لایه SEI پایدار است و این موضوع نیز در استفاده از باتریهای O2-Li اثبات شد. برای استراتژی دوم، قرار دادن غشای اضافی روی آند فلز لیتیوم یک روش محبوب است. با افزودن این لایه محافظ، عمر سیکلی آن در مقایسه با سلول لیتیوم خالی، بیش از 3 2 برابر افزایش خواهد داشت.
نتیجه گیری
فعالیت کاتالیستی مواد کاتدی یکی از مهمترین پارامترهایی است که به طور مستقیم عملکرد الکتروشیمیایی باتریهای لیتیوم-هوا را تعیین میکند. مواد بر پایه کربن، به ویژه مواد پایه کربنی دوپ شده با اتمهای مختلف، دارای هدایت الکتریکی بالا، تخلخل قابل تنظیم و هزینه کم هستند. با این حال، فعالیت کاتالیستی و پایداری سیکلی آنها به اندازه کافی خوب نیست. در مقابل، مواد مبتنی بر فلز معمولا فعالیت کاتالیستی بسیار خوبی را نشان میدهند. با این حال، فلزات گرانبها نسبتاً گران هستند، اکسیدهای فلزی از رسانایی الکترونیکی پایینی برخوردار هستند، فلزات و ترکیبات آنها کاملا مناسب هستند. بنابراین، کامپوزیتهای فلزی و مواد کربنی میتوانند بسیاری از برتریهای منحصر به فرد از جمله عدم محدودیت برای بهبود هدایت الکترونیکی، ارائه مکانهای فعال، پراکندگی نانوذرات و بزرگ کردن سطح ویژه را ارائه دهند.